Στη Χημεία της Α’ Λυκείου, κεφάλαιο 3: ΟΞΕΑ – ΒΑΣΕΙΣ – ΑΛΑΤΑ – ΟΞΕΙΔΙΑ, υποενότητα 3.2 Οξέα και Βάσεις, διδάσκεται η μέτρηση της οξύτητας των διαλυμάτων. Μία από της εργαστηριακές ασκήσεις που εκτελούν οι μαθητές/μαθήτριες είναι η μέτρηση της οξύτητας του ελαιολάδου.
To pH
Σε κάθε υδατικό διάλυμα οξέος ή βάσης υπάρχουν κατιόντα υδρογόνου (Η+) και ανιόντα υδροξειδίου (ΟΗ-). Οι ποσότητες αυτές των ιόντων καθορίζουν το πόσο όξινο ή βασικό είναι το διάλυμα.
Έτσι, αν το πλήθος των Η+ είναι μεγαλύτερο από αυτό των ΟΗ-, τότε το διάλυμα χαρακτηρίζεται όξινο. Αντίθετα, αν το πλήθος των Η+ είναι μικρότερο από των ΟΗ-, τότε το διάλυμα χαρακτηρίζεται βασικό. Τέλος, αν το πλήθος των Η+ είναι περίπου ίδιο με αυτό των ΟΗ-, τότε έχουμε ουδέτερο διάλυμα.
To pH εκφράζει πόσο όξινο ή βασικό είναι ένα διάλυμα, αποτελεί δηλαδή ένα μέτρο της οξύτητας αυτού.
➢ To pH παίρνει πρακτικά τιμές από 0 ως 14. Στα ουδέτερα διαλύματα (π.χ. στο νερό) το pH =7. Στα όξινα διαλύματα έχουμε pH<7 και μάλιστα, όσο μικρότερη είναι η τιμή αυτή, τόσο πιο όξινο είναι το διάλυμα. Στα βασικά διαλύματα έχουμε pH>7 και μάλιστα, όσο μεγαλύτερη είναι η τιμή αυτή, τόσο πιο βασικό είναι το διάλυμα.
Διαγραμματικά έχουμε:
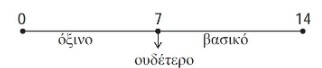
To pH ενός διαλύματος μπορεί να προσδιοριστεί κατά προσέγγιση με τη βοήθεια των δεικτών. Ιδιαίτερα εύχρηστος είναι ο λεγόμενος παγκόσμιος δείκτης (universal), ο οποίος κυκλοφορεί στο εμπόριο συνήθως σε μορφή στενών λωρίδων χαρτιού διαποτισμένων με το δείκτη. Ο δείκτης αυτός για κάθε τιμή του pH από 0 ως 14 παίρνει διαφορετικό χρώμα και μάλιστα με τη σειρά που έχουν τα χρώματα στο φάσμα του λευκού φωτός (ουράνιο τόξο), όπως φαίνεται στο παρακάτω σχήμα.
Η ακριβής, όμως, μέτρηση του pH διαλύματος γίνεται με ένα όργανο που λέγεται πεχάμετρο.
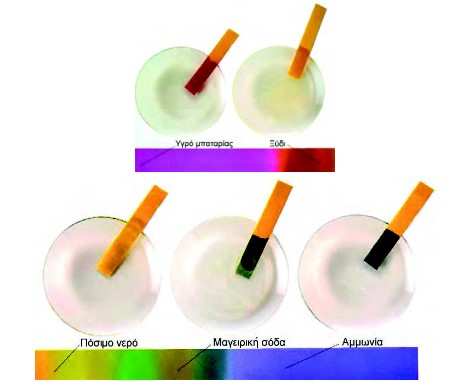
To pH έχει πολλές εφαρμογές στην καθημερινή μας ζωή. Στην τηλεόραση πολλές φορές έχουμε ακούσει τον όρο pH στις διαφημίσεις των σαμπουάν, των σαπουνιών κλπ. Σήμερα γνωρίζουμε το pH πολλών βιολογικών υγρών, χυμών, ποτών και ειδών διατροφής. Στο σχήμα που ακολουθεί φαίνονται οι τιμές pH μερικών γνωστών διαλυμάτων:
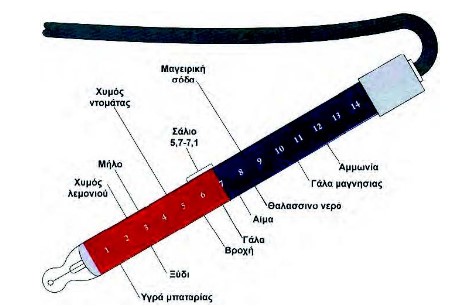
Μία από της πιο γνωστές εφαρμογές υπολογισμού της οξύτητας είναι αυτή του ελαιολάδου για το χαρακτηρισμό του ως έξτρα παρθένο ή παρθένο ελαιόλαδο και φυσικά την αντίστοιχη διαμόρφωση της τιμής του.
Ογκομέτρηση (Οξυμετρία – Αλκαλιμετρία)
Ογκομέτρηση είναι η διαδικασία ποσοτικού προσδιορισμού μιας ουσίας με μέτρηση του όγκου διαλύματος γνωστής συγκέντρωσης (πρότυπου διαλύματος) που χρειάζεται για την πλήρη αντίδραση με την ουσία.
Η μέτρηση του όγκου του πρότυπου διαλύματος γίνεται με προχοΐδα, ενώ το ογκομετρούμενο διάλυμα (άγνωστο διάλυμα) τοποθετείται συνήθως σε κωνική φιάλη.
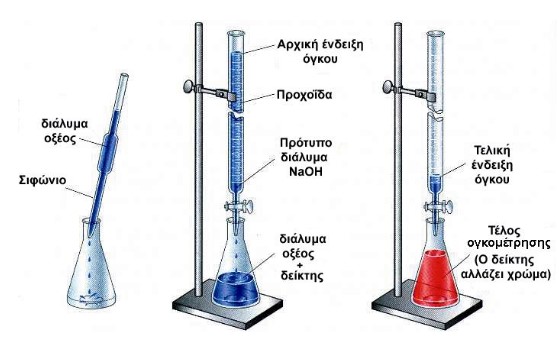
- Ισοδύναμο σημείο είναι το σημείο της ογκομέτρησης, όπου έχει αντιδράσει πλήρως η ουσία (στοιχειομετρικά) με ορισμένη ποσότητα του πρότυπου διαλύματος.
Ο εντοπισμός του ισοδύναμου σημείου διασφαλίζεται με τη βοήθεια των δεικτών, οι οποίοι αποκαλύπτουν το ισοδύναμο σημείο με την αλλαγή του χρώματος τους.
- Το σημείο όπου παρατηρείται χρωματική αλλαγή του ογκομετρούμενου διαλύματος ονομάζεται τελικό σημείο ή πέρας ογκομέτρησης.
Όσο πιο κοντά είναι το ισοδύναμο σημείο με το τελικό σημείο τόσο πιο ακριβής είναι η ογκομέτρηση.
Η οξυμετρία είναι ο κλάδος της ογκομετρίας που περιλαμβάνει προσδιορισμούς συγκεντρώσεων βάσεων με πρότυπο διάλυμα οξέος. Ενώ, αλκαλιμετρία έχουμε όταν ογκομετρείται ένα οξύ με πρότυπο διάλυμα βάσης. Η αλκαλιμετρία – οξυμετρία με άλλα λόγια είναι ογκομετρήσεις που στηρίζονται σε αντιδράσεις εξουδετέρωσης.
Κατά τη διάρκεια της ογκομέτρησης με οξέα ή βάσεις (οξυμετρία ή αλκαλιμετρία) το pH του ογκομετρούμενου διαλύματος μεταβάλλεται συνεχώς.
Ογκομέτρηση ασθενούς οξέος με ισχυρή βάση
Η ογκομέτρηση διαλύματος ελαιολάδου γίνεται με πρότυπο NaOH. Κατάλληλος δείκτης για την ογκομέτρηση αυτή είναι π.χ. η φαινολοφθαλεΐνη, καθώς το πεδίο pH αλλαγής χρώματος του περιλαμβάνει το ισοδύναμο σημείο.
Στο εκπαιδευτικό βίντεο που ακολουθεί περιγράφεται αναλυτικά η διαδικασία της μέτρησης της οξύτητας του ελαιολάδου.
Συμβουλές για σωστή διεξαγωγή της πειραματικής διαδικασίας
- Παίρνουμε την κωνική φιάλη που έχουμε ρίξει το λάδι και τα ξεπλύματα και ρίχνουμε 8-10 σταγόνες φαινολοφθαλεΐνη. και αρχίζουμε να ρίχνουμε το διάλυμα της προχοΐδας στην κωνική φιάλη σταγόνα –σταγόνα σιγά σιγά.
- Παρατηρούμε πως σχηματίζεται ελαφρύ κόκκινο χρώμα όπου εξαφανίζεται αν το αναταράξουμε ή ανακατέψουμε δυνατά.
- Όταν αυτή η ελαφριά κόκκινη (πορτοκαλί) απόχρωση δεν μπορεί πια να εξαφανιστεί με ανατάραξη μέσα σε 5-10 δευτερόλεπτα όσο δυνατά και να ταράξουμε το λάδι τότε σταματάμε να στάζουμε διάλυμα. Τ ότε τα κυβικά εκατοστά της προχοΐδας δηλαδή εκεί που βρίσκεται η επιφάνεια του διαλύματος μας λένε την οξύτητα του λαδιού σε ελαϊκό οξύ.
- Πρέπει να προσέχουμε να στάζουν πολύ σιγά οι σταγόνες και μόλις παίρνει ελαφρύ χρώμα το λάδι να το αναταράζουμε για να βλέπουμε αν εξαφανίζεται .Αν οι σταγόνες πέφτουν γρήγορα δε θα προλάβουμε και θα πέσουν παραπάνω σταγόνες από αυτές που χρειάζονται. Έτσι θα νομίζουμε πως το ελαιόλαδο έχει μεγαλύτερη οξύτητα.
- Σημασία έχει να μην εξαφανίζεται το χρώμα μόνο μέχρι 5-10 δευτερόλεπτα και αυτό αρκεί, γιατί το χρώμα δε διατηρείται ποτέ για μεγάλο χρονικό διάστημα.
Βιβλιογραφικές Πηγές
- http://ebooks.edu.gr/ebooks/v/html/8547/2756/Chimeia_A-Lykeiou_html-empl/index3_2.html
- http://ebooks.edu.gr/ebooks/v/html/8547/2672/Chimeia-T2_G-Lykeiou-ThSp-SpYg_html-empl/index5_6.html
- https://agrotikistegi.gr/images/stories/oliveoil1.pdf
- https://www.youtube.com/@noobscience
- Οδηγίες για οξυμέτρηση ελαιολάδου


